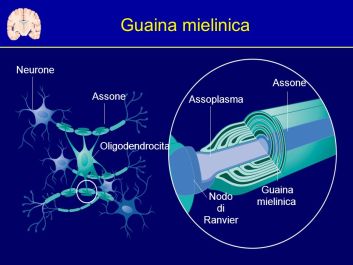
La sclerosi multipla danneggia la guaina mielinica che avvolge le cellule nervose (neuroni) e che permette la conduzione veloce degli impulsi nervosi, causando l’interruzione della trasmissione alla base dei deficit neurologici presenti nella malattia
Com’è noto, la sclerosi multipla – una delle più gravi patologie del sistema nervoso centrale della quale ad oggi non si conoscono ancora esattamente né le cause né una cura risolutiva – danneggia la guaina mielinica che avvolge i neuroni (le cellule nervose) e che permette la conduzione veloce degli impulsi nervosi, causando l’interruzione della trasmissione alla base dei deficit neurologici presenti nella malattia. La guaina è costituita da oligodendrociti, tipo di cellule nervose che avvolgono i prolungamenti dei neuroni rivestendoli appunto di mielina, proteggendoli e rendendoli funzionali.
Una nuova strategia farmacologica riparativa per la sclerosi multpla, non ancora attuabile a causa della mancanza di farmaci adatti, consisterebbe nel promuovere la maturazione dei precursori degli oligodendrociti ancora presenti nel cervello adulto, permettendo così la sostituzione di quelli danneggiati dalla malattia. Sui precursori degli oligodendrociti, infatti, sono presenti alcuni recettori, che, una volta attivati, hanno proprio la capacità di favorire la maturazione di queste cellule. Due di questi recettori, vicini dal punto di vista evolutivo e strutturale, GPR17 e CXCR4, quando attivati dalle proprie molecole (ligandi), sono in grado di aumentare il numero di oligodendrociti maturi e quindi rappresentano nuovi potenziali bersagli per terapie riparative della mielina in malattie quali la sclerosi multipla.
Ebbene, nei giorni scorsi è stato pubblicato dalla rivista scientifica «Cell Signalling» uno studio che ha identificato un nuovo comportamento promiscuo di GPR17, uno dei due recettori che, come si è detto, è in grado di contrastare la perdita di mielina nel sistema nervoso centrale.
In tale lavoro, svolto dall’Università di Milano e cofinanziato dalla FISM, la Fondazione Italiana Sclerosi Multipla che opera a fianco dell’AISM (Associazione Italiana Sclerosi Multipla), i ricercatori hanno identificato un meccanismo comune che collega i recettori GPR17 e CXCR4, mostrando per la prima volta che SDF-1, molecola specifica di quest’ultimo, è in grado di attivare in modo promiscuo anche GPR17. Un’osservazione, quindi, che spiega il ruolo chiave di GPR17, capace cioè di rispondere a differenti segnali, tra cui quelli infiammatori come SDF-1, che sono una componente rilevante di numerose malattie neurodegenerative, tra cui la sclerosi multipla. Il tutto potrebbe dunque contribuire a chiarire meccanismi importanti per prevenire la progressione di quest’ultima.
Inoltre, i risultati ottenuti – suggerendo che sia proprio l’accumulo eccessivo di SDF-1 nei siti delle lesioni demielinizzanti ad attivare in maniera abnorme GPR17, causando il blocco degli oligodendrociti a uno stadio immaturo – aprono la strada a nuove strategie terapeutiche, mirate da un lato alla riparazione della mielina, dall’altro a contrastare l’eccessiva attivazione di GPR17 nelle fasi dell’infiammazione acuta.
È già da molto tempo che il gruppo di Biochimica e Biofisica Computazionale dell’Università di Milano, coordinato da Ivano Eberini, si sta dedicando alla modellazione della struttura di GPR17 e, in collaborazione con il gruppo di Maria Pia Abbracchio dello stesso Ateneo, e di Claudia Martini e Maria Letizia Trincavelli dell’Università di Pisa, a sviluppare nuove molecole in grado di attivare, proprio attraverso GPR17, la produzione di nuova mielina. Dal canto suo, la FISM, negli ultimi anni, finanzia e partecipa attivamente a queste ricerche. (B.E. e S.B.)
Per ulteriori informazioni e approfondimenti: Ufficio Stampa AISM (Barbara Erba), barbaraerba@gmail.com.


